plasticker-News
| 19.02.2013, 06:01 Uhr | Lesedauer: ca. 1 Minute |

|
Evonik: VESTAKEEP® PEEK erhält FDA 510(k)-Zulassung für Wirbelsäulenimplantate
|
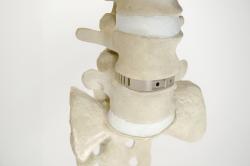
Das Wirbelsäulenimplantat K7C™ Spacer hat die 510(k)-Zulassung der US Food and Drug Administration (FDA) erhalten. Bei diesem zervikalen Spacer handelt es sich um eines von mehreren Wirbelsäulenimplantaten, die von der K7 LLC entwickelt und aus VESTAKEEP ® PEEK von Evonik Industries hergestellt werden, teilt der Rohstoffhersteller mit. Laut K7 LLC sei die 510(k)-Zulassung der FDA größtenteils den besonderen mechanischen Eigenschaften von VESTAKEEP® PEEK zu verdanken. Damit habe erstmals ein spinales Fusionsimplantat auf Basis von VESTAKEEP® eine 510(k)-Zulassung der FDA erhalten. „Wir könnten mit den Testergebnissen und der Materialbeständigkeit von VESTAKEEP® PEEK nicht zufriedener sein“, freut sich Michael Smith, Firmengründer und CEO der K7 LLC. „Die Festigkeit und zusätzliche Duktilität haben uns neue Möglichkeiten bei der Gestaltung unserer PEEK-Implantate eröffnet.“ „Diese Zulassung bestätigt die Produktqualität von VESTAKEEP® PEEK und die Qualität des Masterfiles (MAF)“, sagt Sanjeev Taneja, Vizepräsident von High Temperature Polymers bei Evonik. „Die Zulassung untermauert außerdem das langfristige Engagement von Evonik im Bereich Medizinprodukte und Orthopädie.“ Weitere Informationen: www.evonik.com |
Evonik Industries AG, Essen
» insgesamt 347 News über "Evonik" im News-Archiv gefunden
Ihre News im plasticker? Bitte senden Sie Ihre Pressemitteilungen an redaktion@plasticker.de!








 Wir informieren Sie schnell, umfassend und kostenlos über das, was
in der Branche passiert.
Wir informieren Sie schnell, umfassend und kostenlos über das, was
in der Branche passiert.

